La Universidad de Salamanca ha presentado el nuevo Microscopio Láser Microdisector (LMD), incorporado al Servicio de Patología Molecular Comparada del Centro de Investigación del Cáncer de Salamanca (CIC). Este equipo, ya en funcionamiento, fue adquirido en el marco de la convocatoria de concesión de ayudas para la adquisición de equipamiento científico – técnico del Ministerio de Economía y Competitividad (MINECO), que ha aportado un 80% de los 295.047,61 € totales, invertidos de manera conjunta entre esta institución y la USAL.
A la presentación, que tuvo lugar esta mañana en el CIC, han asistido Juan Manuel Corchado, vicerrector de Investigación y Transferencia; Eugenio Santos, director del Centro de Investigación del Cáncer; Alberto Orfao, director del Servicio General de Citometría del CIC, y Carmen García, responsable del Servicio de Patología Molecular Comparada del Centro.
El Servicio de Patología Molecular Comparada del CIC, al ser una entidad de apoyo a la investigación, se ve dotada de este nuevo microscopio láser con la intención de ofrecer sus funcionalidades de forma abierta a la comunidad científica y a aquellos grupos clínicos que así lo soliciten. La importancia de la adquisición de este equipo para los investigadores es evidente si se conocen sus aplicaciones, que han permitido mejorar las técnicas de la investigación biomédica.
Funcionalidades del LMD
Los sistemas de microdisección láser son equipos clave en la caracterización molecular de células individuales en los tejidos sólidos complejos. En los últimos años se ha confirmado la heterogeneidad celular dentro de un tejido tumoral, por lo que ya sea para investigación o para diagnóstico, es necesario analizar de forma individualizada cada uno de los tipos celulares existentes en un tejido, como pueden ser las células madre tumorales o la presencia de múltiples clones en un tejido. El análisis convencional, mediante microscopios de fluorescencia, proporciona una gran cantidad de información de estos tipos celulares.
Sin embargo, el desarrollo de las últimas tecnologías genómicas y proteómicas –relativas al estudio del genoma y las proteínas expresadas en el mismo, respectivamente- hacen imprescindible el disponer de cada uno de esos tipos celulares purificados para permitir su análisis molecular y realizar estudios como los mencionados anteriormente o también la transcriptómica, que se encargan del conjunto de ácidos ribonucleicos (RNA) presentes en una célula.
De esta forma se pueden identificar cuáles son las diferencias que se presentan respecto al resto de estirpes celulares, con el objetivo último de identificar nuevas dianas moleculares (componente del organismo en el que “actúa el fármaco”), detectar mutaciones concretas u obtener mRNA en diferentes subpoblaciones celulares de tejidos complejos. Mediante estos análisis se podría identificar las rutas celulares alteradas y así estudiar el origen de la enfermedad y, en definitiva, los posibles tratamientos.
Esta misma aproximación es necesaria cuando se estudian los casos de recidiva –la reincidencia de una enfermedad recientemente curada en un paciente- de un tumor previo. Así, se pueden estudiar las células resistentes al tratamiento y analizar directamente en ellas las rutas de resistencia a fármacos, para identificar qué mecanismos moleculares (nuevas mutaciones o modificaciones epigenéticas, entre otros) las hacen resistentes y poder identificar así nuevos fármacos.
Avances para la investigación en tejidos sólidos complejos
En el caso de los tejidos líquidos (sangre, médula ósea, líquido cefalorraquídeo…) los equipos de separación celular basados en citometría de flujo multiparamétrica han sido fundamentales tanto para los estudios antes referidos como en la enfermedad mínima residual o las células madre circulantes, entre otras.
Sin embargo, para los tejidos sólidos complejos, con múltiples poblaciones celulares y cantidades pequeñas de células diana, el equipo de referencia para la obtención de poblaciones celulares puras es el microdisector laser guiado por microscopía (ya sea óptica o de fluorescencia) que permite identificar las células de interés de manera específica mediante el uso de múltiples marcadores.
Además, esto permite la obtención de poblaciones celulares puras a partir de tejidos sólidos, un enfoque fundamental en la investigación traslacional, enfocada al paciente, aunque también para el diagnóstico clínico y la investigación básica.
Descripción técnica del nuevo equipo
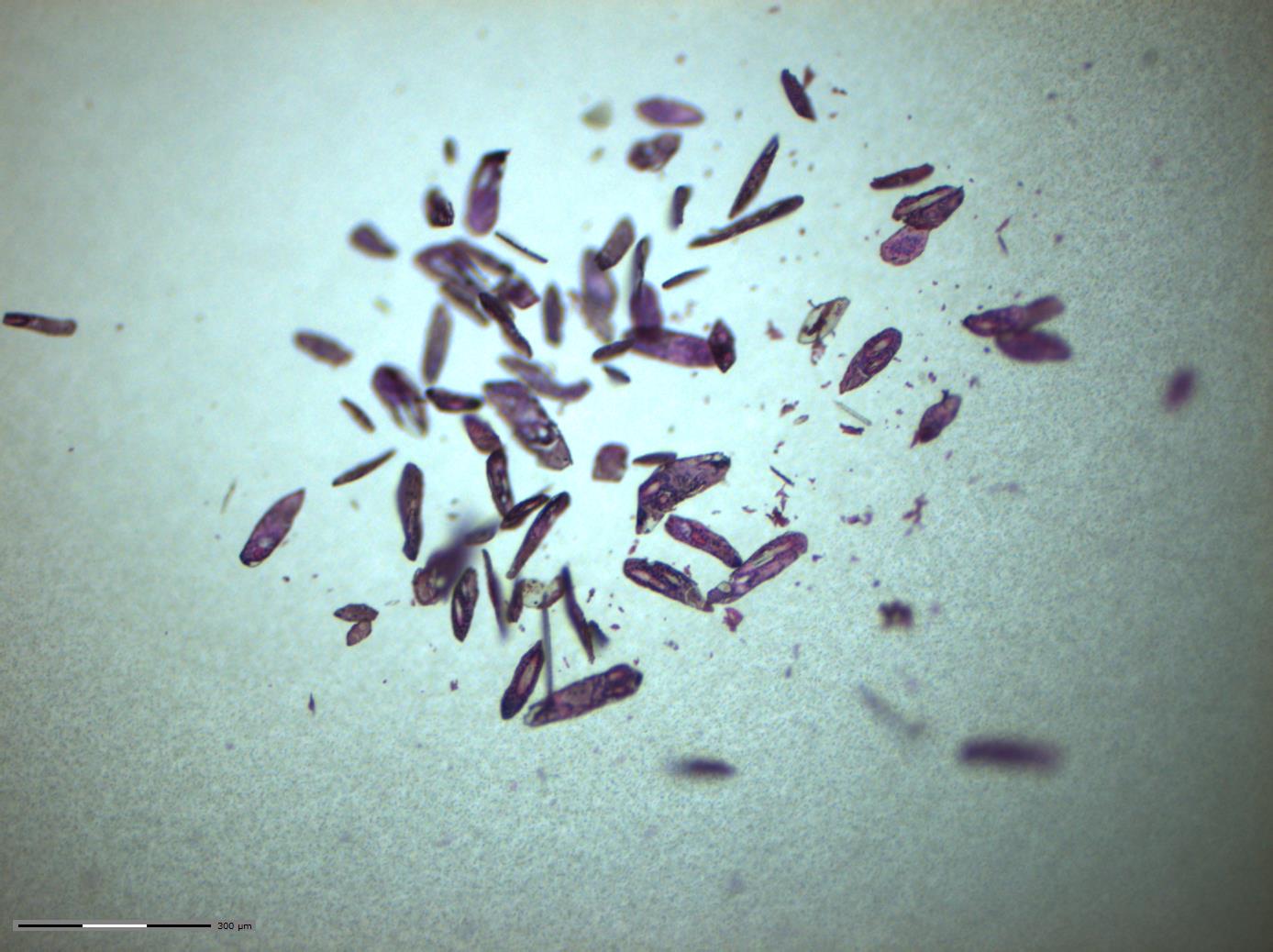
El equipo adquirido es un microdisector láser para la selección y recuperación de células específicas a partir de una preparación microscópica. Las células de interés se pueden identificar tanto con tinción Hematoxilina/Eosina como con marcadores específicos, mediante inmunohistoquímica o inmunofluorescencia. El equipo se completa con un láser pulsante de estado sólido de 355 nm para su resección y colecta.
El láser pulsante está acoplado al puerto trasero del microscopio para facilitar la microdisección de muestras biológicas. Debido al uso combinado del microscopio y del láser es posible aislar el área de interés de la muestra con gran precisión, alta pureza y sin contacto directo, y luego depositar los fragmentos de interés en los depósitos de recogida del sistema para su uso en posteriores análisis. El sistema tiene una elevada flexibilidad para adaptarse a múltiples necesidades en función del tipo de muestra (tamaño, tejido, orgánulos subcelulares…) y los objetivos perseguidos (célula individual, células fijadas, células vivas…).
Para lograrlo, el sistema dispone de:
• Varios formatos de recogida: Desde recipientes individuales hasta placas completas de 96 pocillos
• Posibilidad de elección entre varios insertos de platina, apropiados para 3 portas, o un porta grande (50x76) como los utilizados para secciones completas de cerebro, y placas para célula viva de diferentes tamaños (35mm y 50mm)
• Platina automotriz, que en combinación con el láser fijo puede microdisecar áreas más grandes que el campo de visión y muestras tan pequeñas como fragmentos de cromosomas.
• Colector para célula viva, que proporciona una esterilidad absoluta incluso para células individuales sin necesidad de hardware o software adicionales
• Capacidad para trabajar con la muestra en su formato estándar (. portas de cristal o tubos de microcentrífuga) sin necesidad de trasladar la muestra a formatos específicos, con el consiguiente riesgo de disminución de la integridad/viabilidad de la misma.
• Gran flexibilidad para usar una gran variedad de muestras y preparaciones (diferentes espesores de tejido, humedad, portas, cápsulas…) debido a la potencia del láser y a la tecnología LCM patentada.
• Modo específico LCM para la microdisección de material archivado montado en portas de cristal sin necesidad de paso previo de transferencia a portas específicos con la máxima protección de la muestra usando pulsos de láser desfocalizados.
• Posibilidad de usar el sistema para el estudio de ablación celular o sub-celular y combinarlo con varios tipos de microscopía de fluorescencia
• Sistema de fluorescencia avanzada con una amplia variedad de filtros.