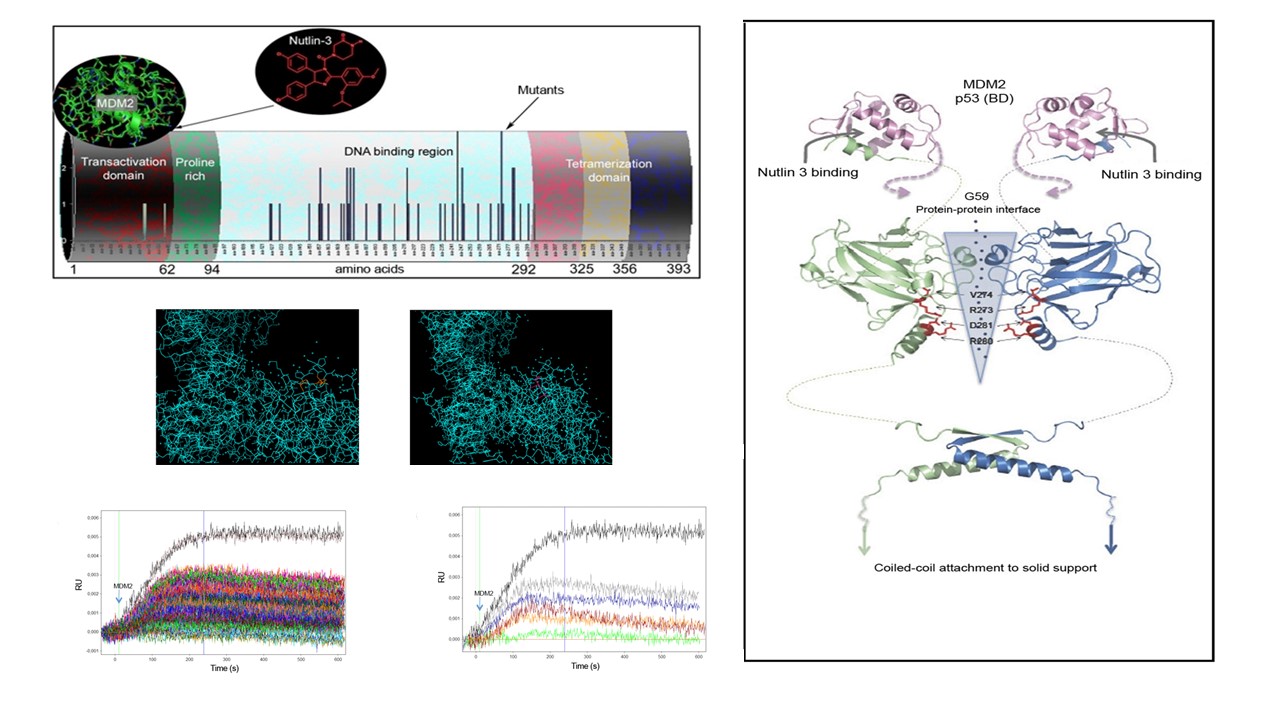
Los genes que han mutado y contribuyen al desarrollo de un cáncer son denominados oncogenes. Uno de los oncogenes más relevantes en procesos tumorales es p53 y además está considerado uno de los guardianes del genoma. Se estima que más del 70% de los tumores sólidos y hematológicos presentan mutaciones puntuales de p53. Por esta razón, en la investigación tiene una gran relevancia el análisis de p53 tanto para mejorar el diagnóstico como para diseñar nuevos fármacos de determinados tipos de cáncer, Con estos objetivos p53 se emplea como biomarcador diagnóstico y también como diana terapéutica.
El último resultado publicado del grupo dirigido por Manuel Fuentes, investigador del Centro de Investigación del Cáncer (centro mixto de la Universidad de Salamanca y del CSIC), ha seguido este enfoque. Mediante esta investigación se ha caracterizado p53 y las mutaciones puntuales más prevalentes a nivel clínico en su interacción con una proteína, conocida como MDM2, y un fármaco inhibidor de dicha interacción.
En concreto, se ha diseñado y desarrollado un sistema in vitro, que permite evaluar en tiempo real cómo la mutación puntual (se han analizado las 75 mutaciones clínicas más relevantes) puede afectar a la eficacia del fármaco Nutlin3. En este estudio, se han identificado tres grupos de mutaciones de p53: i) aquellas que pueden inducir resistencia al fármaco, dado que no se ha detectado interacción con el fármaco y MDM2; ii) aquellas que siguen siendo sensibles al fármaco; y iii) por último, otras mutaciones que con un efecto intermedio podrían, tal vez, implicar a nivel terapéutico un pequeño incremento de la dosis, siempre dentro de los márgenes de bioseguridad del fármaco.
Esta investigación -en su conjunto- es un ejemplo de aproximaciones multidisciplinares muy útiles en medicina de precisión. Este estudio abre una nueva perspectiva en el análisis masivo de proteínas tumorales y nuevos fármacos, dado que permite identificar nuevas dianas, así como aportar información- en un solo paso y en tiempo real- de la afinidad de los fármacos con la proteína de interés.
Además, esta investigación implica la innovación tecnológica de haber diseñado y desarrollado una nueva estrategia de proteómica funcional de base nanotecnológica, que ha sido empleada con éxito en la evaluación del efecto de posibles fármacos en uno de los marcadores tumorales más conocidos y de relevancia clínica. Junto a esto, se ha realizado la integración con el análisis in silico a nivel estructural, demostrando además así la compatibilidad de esta aproximación con la química computacional, muy relevante para el diseño y desarrollo de nuevos fármacos.
Estos resultados, debido a las características de p53, abren la posibilidad de que se puedan combinar los tratamientos dirigidos a las células cancerígenas junto con inmunoterapia oncológica. En este sentido, se enfocan varios proyectos abiertos en la línea de investigación del laboratorio al que está vinculado el Dr. Fuentes.

Gráfico de las interacciones de p53
Esta investigación se puede aplicar para determinar cómo las mutaciones puntuales de p53 pueden afectar al tratamiento en varios tumores con estos fármacos. Porque mediante la metodología de análisis propuesta se permite no solo estudiar la interacción del fármaco con su diana, sino que además permite la comparación simultanea -en un solo paso- de múltiples mutaciones puntuales. Esta rápida determinación in vitro facilita discriminar rápidamente entre los mutantes de p53 sensibles y los mutantes resistentes al tratamiento, lo cual permite abrir nuevas perspectivas terapéuticas.
El presente trabajo es altamente multidisciplinar, dado que abarca desde la biología molecular para el clonaje y subclonaje de las mutaciones puntuales de p53, la biotecnología para la producción in situ de las proteínas en un sistema libre de células, bioinformática para análisis estructural de proteínas y análisis de datos masivos (big data), y el diseño y desarrollo de la plataforma de proteómica funcional para el análisis simultáneo de todas las interacciones con una elevada resolución a diferentes concentraciones de fármaco.
El investigador responsable del trabajo es Manuel Fuentes, profesor titular del área de Inmunología en el departamento de medicina de la Universidad de Salamanca e investigador en el Centro de Investigación del Cáncer (Instituto de Biología Molecular y Celular del cáncer -IBMCC). Además, el grupo de investigación forma parte de Conexión NanoMedicina del CSIC y de la Plataforma Interdisciplinar Salud Global (PTI+Salud Global), también del CSIC. Manuel Fuentes dirige el grupo “Proteómica funcional y NanoMedicina” del IBSAL.
El trabajo es fruto de una colaboración internacional desarrollada en los últimos años; la cual ha sido liderado desde el Centro de Investigación del Cáncer-IBMCC (Universidad de Salamanca-CSIC), y en la que han participado la Universidad de Pittsburgh (EE.UU.), el Biodesign Institute (EE.UU.) y el Instituto Tecnológico de Bombay (India).